C จัดเรียงสัมประสิทธิ์ วิธีวางสัมประสิทธิ์ในสมการเคมี
สมการปฏิกิริยาในวิชาเคมีคือการบันทึกกระบวนการทางเคมีโดยใช้สูตรทางเคมีและสัญลักษณ์ทางคณิตศาสตร์
สัญกรณ์นี้เป็นแผนภาพของปฏิกิริยาเคมี เมื่อเครื่องหมาย "=" ปรากฏขึ้น จะเรียกว่า "สมการ" มาลองแก้กันดู.
ตัวอย่างการวิเคราะห์ปฏิกิริยาอย่างง่าย
แคลเซียมมีหนึ่งอะตอมเนื่องจากค่าสัมประสิทธิ์ไม่คุ้มค่า ดัชนีไม่ได้เขียนที่นี่ซึ่งหมายถึงหนึ่ง ทางด้านขวาของสมการ Ca ก็เป็นหนึ่งเช่นกัน เราไม่จำเป็นต้องทำงานกับแคลเซียม
มาดูองค์ประกอบถัดไป - ออกซิเจน ดัชนี 2 บ่งชี้ว่ามีไอออนออกซิเจน 2 ตัว ไม่มีดัชนีทางด้านขวานั่นคือออกซิเจน 1 อนุภาค และทางด้านซ้ายมี 2 อนุภาค เรากำลังทำอะไรอยู่? ไม่มีดัชนีหรือการแก้ไขเพิ่มเติม สูตรเคมีคุณไม่สามารถป้อนได้เนื่องจากเขียนถูกต้อง
ค่าสัมประสิทธิ์คือสิ่งที่เขียนไว้หน้าส่วนที่เล็กที่สุด พวกเขามีสิทธิที่จะเปลี่ยนแปลง เพื่อความสะดวก เราจะไม่เขียนสูตรใหม่ ทางด้านขวา เราคูณ 2 เพื่อให้ได้ออกซิเจน 2 ไอออนตรงนั้น

หลังจากที่เราตั้งค่าสัมประสิทธิ์แล้ว เราก็ได้แคลเซียม 2 อะตอม มีเพียงอันเดียวทางด้านซ้าย ซึ่งหมายความว่าตอนนี้เราต้องใส่ 2 ไว้หน้าแคลเซียม

ตอนนี้เรามาตรวจสอบผลลัพธ์กัน ถ้าจำนวนอะตอมของธาตุทั้งสองข้างเท่ากัน เราก็สามารถใส่เครื่องหมาย "เท่ากัน" ได้

อีกตัวอย่างที่ชัดเจน: มีไฮโดรเจน 2 ตัวทางด้านซ้าย และหลังลูกศร เราก็มีไฮโดรเจน 2 ตัวด้วย

- ก่อนลูกศรจะมีออกซิเจน 2 ตัว แต่ไม่มีดัชนีหลังลูกศร ซึ่งหมายความว่ามีออกซิเจน 1 ตัว
- มีมากขึ้นทางด้านซ้ายและน้อยลงทางด้านขวา
- เราใส่สัมประสิทธิ์ 2 ไว้หน้าน้ำ

เราคูณสูตรทั้งหมดด้วย 2 และตอนนี้ปริมาณไฮโดรเจนก็เปลี่ยนไป เราคูณดัชนีด้วยสัมประสิทธิ์ แล้วเราจะได้ 4 และทางด้านซ้ายจะมีอะตอมไฮโดรเจนเหลืออยู่ 2 อะตอม และเพื่อให้ได้ 4 เราต้องคูณไฮโดรเจนด้วย 2.

ในกรณีนี้คือเมื่อองค์ประกอบในสูตรหนึ่งและอีกสูตรหนึ่งอยู่ด้านเดียวกันจนถึงลูกศร

ไอออนซัลเฟอร์ 1 ตัวทางด้านซ้าย และ 1 ไอออนทางด้านขวา อนุภาคออกซิเจน 2 อนุภาค และออกซิเจนอีก 2 อนุภาค หมายความว่ามีออกซิเจน 4 ตัวทางด้านซ้าย ด้านขวามีออกซิเจน 3 อัน นั่นคือในอีกด้านหนึ่งปรากฎ เลขคู่อะตอม และอีกอันหนึ่งก็คี่ ถ้าเราคูณเลขคี่ด้วยสองเท่า เราจะได้เลขคู่ ก่อนอื่นเราทำให้มันมีค่าเท่ากัน เมื่อต้องการทำเช่นนี้ ให้คูณสูตรทั้งหมดหลังลูกศรด้วย 2 หลังจากการคูณ เราจะได้ออกซิเจนไอออน 6 ไอออน และอะตอมกำมะถัน 2 อะตอม ทางด้านซ้ายเรามีอนุภาคกำมะถันหนึ่งอนุภาค ทีนี้มาทำให้มันเท่ากันกันเถอะ เราใส่สมการทางซ้ายก่อนสีเทา 2

เรียกว่า.
ปฏิกิริยาที่ซับซ้อน
ตัวอย่างนี้ซับซ้อนกว่าเนื่องจากมีองค์ประกอบของสสารมากกว่า

สิ่งนี้เรียกว่าปฏิกิริยาการทำให้เป็นกลาง สิ่งที่ต้องทำให้เท่ากันที่นี่ก่อน:
- ทางด้านซ้ายมีโซเดียมอะตอมหนึ่งอะตอม
- ทางด้านขวาดัชนีบอกว่ามีโซเดียม 2 ตัว
ข้อสรุปชี้ให้เห็นว่าคุณต้องคูณสูตรทั้งหมดด้วยสอง

ทีนี้มาดูกันว่ามีกำมะถันมากแค่ไหน หนึ่งด้านซ้ายและขวา มาใส่ใจกับออกซิเจนกันดีกว่า ทางด้านซ้ายมีอะตอมออกซิเจน 6 อะตอม ในทางกลับกัน - 5- ด้านขวาน้อยลง ด้านซ้ายมากขึ้น ต้องนำเลขคี่มาเป็นเลขคู่ ในการทำเช่นนี้ เราจะคูณสูตรของน้ำด้วย 2 นั่นคือจากออกซิเจน 1 อะตอมที่เราได้เป็น 2
ขณะนี้มีอะตอมออกซิเจนอยู่ 6 อะตอมทางด้านขวาแล้ว นอกจากนี้ยังมี 6 อะตอมทางด้านซ้าย มาตรวจสอบไฮโดรเจนกันดีกว่า ไฮโดรเจน 2 อะตอมและไฮโดรเจนอีก 2 อะตอม ด้านซ้ายจะมีอะตอมไฮโดรเจน 4 อะตอม และอีกด้านหนึ่งก็มีอะตอมไฮโดรเจนสี่อะตอมด้วย องค์ประกอบทั้งหมดเท่าเทียมกัน เราใส่เครื่องหมายเท่ากับ.

ตัวอย่างถัดไป

ตัวอย่างต่อไปนี้น่าสนใจเนื่องจากมีวงเล็บปรากฏขึ้น พวกเขาบอกว่าถ้ามีตัวประกอบอยู่หลังวงเล็บ แต่ละองค์ประกอบในวงเล็บก็จะถูกคูณด้วยตัวประกอบนั้น คุณต้องเริ่มต้นด้วยไนโตรเจน เนื่องจากมีน้อยกว่าออกซิเจนและไฮโดรเจน ทางด้านซ้ายมีไนโตรเจนหนึ่งอันและทางขวาเมื่อคำนึงถึงวงเล็บก็มีสองอัน

ด้านขวามีอะตอมไฮโดรเจน 2 อะตอม แต่จำเป็นต้องมี 4 อะตอม เราออกจากสิ่งนี้ได้โดยการคูณน้ำด้วยสอง จึงได้ไฮโดรเจนสี่ตัว เยี่ยมเลย ไฮโดรเจนเท่ากัน มีออกซิเจนเหลืออยู่ ก่อนเกิดปฏิกิริยาจะมี 8 อะตอม หลัง - 8 เช่นกัน
เยี่ยมเลย องค์ประกอบทั้งหมดเท่าเทียมกัน เราสามารถกำหนด "เท่ากัน" ได้


ต่อไปคือแบเรียม มันเท่ากันแล้ว คุณไม่จำเป็นต้องแตะมัน ก่อนเกิดปฏิกิริยาจะมีคลอรีนสองตัว หลังจากนั้นจะมีคลอรีนเพียงตัวเดียว จะต้องทำอะไร? วาง 2 หน้าคลอรีนหลังทำปฏิกิริยา

ทีนี้ เนื่องจากค่าสัมประสิทธิ์ที่เพิ่งตั้งไว้ หลังจากปฏิกิริยา เราได้โซเดียม 2 ตัว และก่อนปฏิกิริยา เราก็ได้โซเดียม 2 ตัวด้วย เยี่ยมมาก ทุกอย่างเท่าเทียมกัน

คุณยังสามารถปรับสมดุลปฏิกิริยาโดยใช้วิธีสมดุลอิเล็กทรอนิกส์ได้อีกด้วย วิธีนี้มีกฎหลายข้อที่สามารถนำมาใช้ได้ ขั้นตอนต่อไปคือการจัดเรียงสถานะออกซิเดชันขององค์ประกอบทั้งหมดในแต่ละสารเพื่อทำความเข้าใจว่าออกซิเดชันเกิดขึ้นที่ใดและเกิดการรีดักชันที่ใด
วันนี้เราจะมาพูดถึงวิธีการตั้งอัตราต่อรอง สมการทางเคมี- คำถามนี้ไม่เพียงสนใจนักเรียนมัธยมปลายของสถาบันการศึกษาทั่วไปเท่านั้น แต่ยังรวมถึงเด็ก ๆ ที่เพิ่งทำความคุ้นเคยกับองค์ประกอบพื้นฐานของวิทยาศาสตร์ที่ซับซ้อนและน่าสนใจด้วย หากเข้าใจในระยะแรก ปัญหาในการแก้ปัญหาจะไม่ปรากฏอีกในอนาคต ลองคิดดูตั้งแต่ต้น
สมการคืออะไร
โดยทั่วไปเป็นที่เข้าใจกันว่าเป็นการบันทึกทั่วไปของปฏิกิริยาเคมีที่เกิดขึ้นระหว่างรีเอเจนต์ที่เลือก สำหรับกระบวนการดังกล่าว จะใช้ดัชนี สัมประสิทธิ์ และสูตร
อัลกอริธึมการรวบรวม
จะเขียนสมการเคมีได้อย่างไร? ตัวอย่างของการโต้ตอบใดๆ สามารถเขียนได้โดยการสรุปการเชื่อมต่อดั้งเดิม เครื่องหมายเท่ากับบ่งชี้ว่าปฏิกิริยาเกิดขึ้นระหว่างสารที่ทำปฏิกิริยา ต่อไป จะรวบรวมสูตรของผลิตภัณฑ์ตามวาเลนซี (สถานะออกซิเดชัน)
วิธีบันทึกปฏิกิริยา
ตัวอย่างเช่น หากคุณต้องการเขียนสมการทางเคมีเพื่อยืนยันคุณสมบัติของมีเทน ให้เลือกตัวเลือกต่อไปนี้:
- ฮาโลเจน (ปฏิสัมพันธ์ที่รุนแรงกับองค์ประกอบ VIIA ตารางธาตุ D. I. Mendeleev);
- การเผาไหม้ในออกซิเจนในอากาศ
สำหรับกรณีแรก เราจะเขียนสารตั้งต้นไว้ทางด้านซ้าย และผลิตภัณฑ์ผลลัพธ์ทางด้านขวา หลังจากตรวจสอบจำนวนอะตอมขององค์ประกอบทางเคมีแต่ละองค์ประกอบแล้ว เราจะได้บันทึกขั้นสุดท้ายของกระบวนการที่กำลังดำเนินอยู่ เมื่อมีเทนเผาไหม้ในออกซิเจนในอากาศจะเกิดกระบวนการคายความร้อนซึ่งเป็นผลมาจากเหตุนี้ คาร์บอนไดออกไซด์และไอน้ำ
เพื่อให้ตั้งค่าสัมประสิทธิ์ในสมการเคมีได้อย่างถูกต้อง จะใช้กฎการอนุรักษ์มวลของสาร เราเริ่มกระบวนการปรับสมดุลโดยการกำหนดจำนวนอะตอมของคาร์บอน ต่อไปเราจะคำนวณไฮโดรเจนและหลังจากนั้นเราจะตรวจสอบปริมาณออกซิเจนเท่านั้น
โอวีอาร์
สมการเคมีที่ซับซ้อนสามารถปรับสมดุลได้โดยใช้สมดุลของอิเล็กตรอนหรือวิธีครึ่งปฏิกิริยา เรานำเสนอลำดับของการกระทำที่ออกแบบมาเพื่อกำหนดค่าสัมประสิทธิ์ในปฏิกิริยาประเภทต่อไปนี้:
- การสลายตัว;
- การทดแทน

อันดับแรก สิ่งสำคัญคือต้องจัดเตรียมสถานะออกซิเดชันของแต่ละองค์ประกอบในสารประกอบ เมื่อจัดเตรียมสิ่งเหล่านั้นจำเป็นต้องคำนึงถึงกฎเกณฑ์บางประการ:
- สำหรับสารเชิงเดี่ยวจะเป็นศูนย์
- ในสารประกอบไบนารี่ ผลรวมของมันคือ 0
- ในสารประกอบที่มีธาตุตั้งแต่สามธาตุขึ้นไป ธาตุแรกแสดงค่าบวก โดยไอออนที่อยู่นอกสุด - ค่าลบระดับของการเกิดออกซิเดชัน องค์ประกอบกลางคำนวณทางคณิตศาสตร์โดยคำนึงถึงผลรวมต้องเป็น 0
จากนั้นเลือกอะตอมหรือไอออนที่สถานะออกซิเดชันเปลี่ยนแปลงไป เครื่องหมายบวกและลบระบุจำนวนอิเล็กตรอน (รับ, ให้) จากนั้น ตัวคูณที่เล็กที่สุดจะถูกกำหนดระหว่างกัน เมื่อหาร NOC ด้วยตัวเลขเหล่านี้ จะได้ตัวเลขมา อัลกอริทึมนี้จะเป็นคำตอบสำหรับคำถามว่าจะใส่สัมประสิทธิ์ในสมการเคมีได้อย่างไร
ตัวอย่างแรก
สมมติว่าได้รับมอบหมายงาน: "จัดเรียงสัมประสิทธิ์ในปฏิกิริยา กรอกข้อมูลในช่องว่าง กำหนดสารออกซิไดซ์และตัวรีดิวซ์" ตัวอย่างดังกล่าวมีให้กับผู้สำเร็จการศึกษาในโรงเรียนที่เลือกวิชาเคมีเป็นการสอบ Unified State
KMnO 4 + H 2 SO 4 + KBr = MnSO 4 + Br 2 +…+…

ลองทำความเข้าใจวิธีใส่สัมประสิทธิ์ในสมการเคมีที่เสนอให้กับวิศวกรและแพทย์ในอนาคต หลังจากจัดเรียงสถานะออกซิเดชันขององค์ประกอบในวัสดุตั้งต้นและผลิตภัณฑ์ที่มีอยู่ เราพบว่าไอออนแมงกานีสทำหน้าที่เป็นตัวออกซิไดซ์ และไอออนโบรไมด์แสดงคุณสมบัติรีดิวซ์
เราสรุปได้ว่าสารที่ไม่ได้รับนั้นไม่ได้มีส่วนร่วมในกระบวนการรีดอกซ์ ผลิตภัณฑ์ที่ขาดไปอย่างหนึ่งคือน้ำ และอย่างที่สองคือโพแทสเซียมซัลเฟต หลังจากรวบรวมเครื่องชั่งอิเล็กทรอนิกส์แล้ว ขั้นตอนสุดท้ายจะเป็นการตั้งค่าสัมประสิทธิ์ในสมการ
ตัวอย่างที่สอง
มาดูอีกตัวอย่างหนึ่งเพื่อทำความเข้าใจวิธีวางค่าสัมประสิทธิ์ในสมการเคมีประเภทรีดอกซ์
สมมติว่าเราได้รับแผนภาพต่อไปนี้:
P + HNO 3 = ไม่ 2 + … + …
ฟอสฟอรัส ซึ่งตามคำจำกัดความแล้วเป็นสารธรรมดา มีคุณสมบัติรีดิวซ์ ทำให้สถานะออกซิเดชันเพิ่มขึ้นเป็น +5 ดังนั้นหนึ่งในสารที่พลาดไปคือกรดฟอสฟอริก H 3 PO 4 ORR ถือว่ามีสารรีดิวซ์อยู่ซึ่งจะเป็นไนโตรเจน เปลี่ยนเป็นไนตริกออกไซด์ (4) กลายเป็น NO 2

เพื่อที่จะหาค่าสัมประสิทธิ์ในปฏิกิริยานี้ เราจะสร้างเครื่องชั่งอิเล็กทรอนิกส์ขึ้นมา
P 0 ให้ 5e = P +5
N +5 รับ e = N +4
เมื่อพิจารณาว่ากรดไนตริกและไนตริกออกไซด์ (4) ต้องนำหน้าด้วยค่าสัมประสิทธิ์ 5 เราจะได้ปฏิกิริยาที่เสร็จสมบูรณ์:
P + 5HNO 3 = 5NO 2 + H 2 O + H 3 PO 4
ค่าสัมประสิทธิ์สเตอริโอเคมีในเคมีทำให้สามารถแก้ปัญหาการคำนวณต่างๆ ได้
ตัวอย่างที่สาม
เมื่อพิจารณาว่าการจัดเรียงสัมประสิทธิ์ทำให้เกิดปัญหาสำหรับนักเรียนมัธยมปลายจำนวนมาก จึงจำเป็นต้องฝึกลำดับการกระทำโดยใช้ตัวอย่างที่เฉพาะเจาะจง เราขอเสนออีกตัวอย่างหนึ่งของงาน ซึ่งจะต้องอาศัยความรู้เกี่ยวกับวิธีการจัดเรียงสัมประสิทธิ์ในปฏิกิริยารีดอกซ์
H 2 S + HMnO 4 = S + MnO 2 +…

ลักษณะเฉพาะของงานที่เสนอคือจำเป็นต้องทำให้ผลิตภัณฑ์ปฏิกิริยาที่หายไปสมบูรณ์ และหลังจากนั้นเราจึงจะสามารถตั้งค่าสัมประสิทธิ์ต่อไปได้
หลังจากการจัดเรียงสถานะออกซิเดชันของแต่ละองค์ประกอบในสารประกอบแล้ว เราสามารถสรุปได้ว่าแมงกานีสแสดงคุณสมบัติออกซิไดซ์ ซึ่งทำให้เวเลนซ์ของมันลดลง ความสามารถในการรีดิวซ์ในปฏิกิริยาที่นำเสนอนั้นแสดงให้เห็นโดยซัลเฟอร์ ซึ่งถูกรีดิวซ์เป็นสารธรรมดา หลังจากรวบรวมเครื่องชั่งอิเล็กทรอนิกส์แล้ว สิ่งที่เราต้องทำคือจัดเรียงสัมประสิทธิ์ในแผนภาพกระบวนการที่เสนอ และมันก็เสร็จแล้ว
ตัวอย่างที่สี่
สมการทางเคมีเรียกว่ากระบวนการที่สมบูรณ์เมื่อมี อย่างเต็มที่ปฏิบัติตามกฎการอนุรักษ์มวลของสาร จะตรวจสอบรูปแบบนี้ได้อย่างไร? จำนวนอะตอมประเภทเดียวกันที่เข้าสู่ปฏิกิริยาจะต้องสอดคล้องกับจำนวนอะตอมในผลิตภัณฑ์ของปฏิกิริยา เฉพาะในกรณีนี้เท่านั้นที่จะสามารถพูดคุยเกี่ยวกับประโยชน์ของปฏิกิริยาทางเคมีที่บันทึกไว้ความเป็นไปได้ของการใช้งานในการคำนวณและการแก้ปัญหาการคำนวณ ระดับที่แตกต่างกันความซับซ้อน ต่อไปนี้เป็นงานที่แตกต่างออกไปที่เกี่ยวข้องกับการวางค่าสัมประสิทธิ์สเตอริโอเคมีที่หายไปในปฏิกิริยา:
ศรี + …+ HF = H 2 SiF 6 + NO +…

ความยากของงานคือทั้งสารตั้งต้นและผลิตภัณฑ์ปฏิกิริยาหายไป หลังจากตั้งค่าองค์ประกอบทั้งหมดในสถานะออกซิเดชันแล้ว เราจะเห็นว่าอะตอมของซิลิคอนในงานที่เสนอมีคุณสมบัติลดลง ไนโตรเจน (II) มีอยู่ในผลิตภัณฑ์ที่ทำปฏิกิริยา หนึ่งในสารประกอบเริ่มต้นคือกรดไนตริก เราพิจารณาอย่างมีเหตุผลว่าผลิตภัณฑ์ที่ขาดหายไปของปฏิกิริยาคือน้ำ ขั้นตอนสุดท้ายคือการวางค่าสัมประสิทธิ์สเตอริโอเคมีที่เกิดขึ้นลงในปฏิกิริยา
3Si + 4HNO 3 + 18HF = 3H 2 SiF 6 + 4NO + 8 H 2 O
ตัวอย่างปัญหาสมการ
จำเป็นต้องกำหนดปริมาตรของสารละลายไฮโดรเจนคลอไรด์ 10% ซึ่งมีความหนาแน่น 1.05 กรัม/มิลลิลิตร ซึ่งจำเป็นในการทำให้แคลเซียมไฮดรอกไซด์เป็นกลางอย่างสมบูรณ์ซึ่งเกิดขึ้นระหว่างการไฮโดรไลซิสของคาร์ไบด์ เป็นที่ทราบกันว่าก๊าซที่ปล่อยออกมาในระหว่างการไฮโดรไลซิสจะมีปริมาตร 8.96 ลิตร (N.S.) เพื่อที่จะรับมือกับงานนี้ คุณต้องสร้างสมการสำหรับกระบวนการไฮโดรไลซิสของแคลเซียมคาร์ไบด์ก่อน:
CaC 2 + 2H 2 O = Ca (OH) 2 + C 2 H 2
แคลเซียมไฮดรอกไซด์ทำปฏิกิริยากับไฮโดรเจนคลอไรด์ทำให้เกิดการวางตัวเป็นกลางโดยสมบูรณ์:
Ca(OH)2 + 2HCl = CaCl2 + 2H2O

เราคำนวณมวลของกรดที่จำเป็นสำหรับกระบวนการนี้ กำหนดปริมาตรของสารละลายไฮโดรเจนคลอไรด์ การคำนวณทั้งหมดสำหรับปัญหานั้นคำนึงถึงค่าสัมประสิทธิ์สเตอริโอเคมีซึ่งยืนยันความสำคัญของมัน
สรุปแล้ว
การวิเคราะห์ผลลัพธ์ของการสอบสถานะรวมในวิชาเคมีบ่งชี้ว่างานที่เกี่ยวข้องกับการตั้งค่าสัมประสิทธิ์สเตอริโอเคมีในสมการ การสร้างสมดุลทางอิเล็กทรอนิกส์ การกำหนดตัวออกซิไดซ์และตัวรีดิวซ์ทำให้เกิดปัญหาร้ายแรงสำหรับผู้สำเร็จการศึกษาสมัยใหม่ โรงเรียนมัธยมศึกษา- น่าเสียดายที่ผู้สำเร็จการศึกษาสมัยใหม่มีระดับความเป็นอิสระน้อยมาก ดังนั้นนักเรียนมัธยมปลายจึงไม่ทำงานบนพื้นฐานทางทฤษฎีที่ครูเสนอ
ท่ามกลาง ข้อผิดพลาดทั่วไปซึ่งเด็กนักเรียนสมมติเมื่อจัดเรียงสัมประสิทธิ์ในปฏิกิริยา ประเภทต่างๆ, มีข้อผิดพลาดทางคณิตศาสตร์มากมาย ตัวอย่างเช่น ไม่ใช่ทุกคนที่รู้วิธีหาตัวคูณร่วมน้อยหรือหารและคูณตัวเลขอย่างถูกต้อง สาเหตุของปรากฏการณ์นี้คือการลดจำนวนชั่วโมงที่จัดสรรให้กับโรงเรียนการศึกษาเพื่อศึกษาหัวข้อนี้ ในหลักสูตรเคมีขั้นพื้นฐาน ครูไม่มีโอกาสทำงานร่วมกับนักเรียนในประเด็นที่เกี่ยวข้องกับการเตรียมเครื่องชั่งอิเล็กทรอนิกส์ในกระบวนการรีดอกซ์
มีหลายวิธีในการกำหนดค่าสัมประสิทธิ์ในสมการของปฏิกิริยารีดอกซ์ เราใช้วิธีสมดุลทางอิเล็กทรอนิกส์ ซึ่งมีการรวบรวมสมการ OVR ที่สมบูรณ์ตามลำดับต่อไปนี้:
1. เขียนแผนภาพแสดงปฏิกิริยาระบุสารที่ทำปฏิกิริยาและสารที่เกิดจากปฏิกิริยา เช่น
2. กำหนดสถานะออกซิเดชันของอะตอมและเขียนเครื่องหมายและค่าของมันไว้เหนือสัญลักษณ์ขององค์ประกอบ โดยสังเกตองค์ประกอบที่สถานะออกซิเดชันเปลี่ยนแปลงไป:
3. เขียนสมการทางอิเล็กทรอนิกส์สำหรับปฏิกิริยาออกซิเดชันและการรีดักชัน กำหนดจำนวนอิเล็กตรอนที่บริจาคโดยตัวรีดิวซ์และยอมรับโดยตัวออกซิไดซ์ จากนั้นทำให้เท่ากันโดยการคูณด้วยสัมประสิทธิ์ที่เหมาะสม:
4. ค่าสัมประสิทธิ์ที่ได้รับซึ่งสอดคล้องกับความสมดุลทางอิเล็กทรอนิกส์จะถูกโอนไปยังสมการหลัก:
5. ปรับจำนวนอะตอมและไอออนที่ไม่เปลี่ยนสถานะออกซิเดชันให้เท่ากัน (ตามลำดับ: โลหะ อโลหะ ไฮโดรเจน):
6. ตรวจสอบความถูกต้องของการเลือกสัมประสิทธิ์ตามจำนวนอะตอมออกซิเจนทางด้านซ้ายและด้านขวาของสมการปฏิกิริยา - ควรเท่ากัน (ในสมการนี้ 24 = 18 + 2 + 4, 24 = 24)
ลองดูตัวอย่างที่ซับซ้อนกว่านี้:
ให้เราตรวจสอบสถานะออกซิเดชันของอะตอมในโมเลกุล:
มาสร้างสมการทางอิเล็กทรอนิกส์สำหรับปฏิกิริยาออกซิเดชั่นและการรีดักชันและปรับจำนวนอิเล็กตรอนที่กำหนดและยอมรับให้เท่ากัน:
ลองโอนค่าสัมประสิทธิ์ไปที่สมการหลัก:
มาทำให้จำนวนอะตอมเท่ากันที่ไม่เปลี่ยนสถานะออกซิเดชัน:
โดยการนับจำนวนอะตอมออกซิเจนทางด้านขวาและด้านซ้ายของสมการ เราจะตรวจสอบให้แน่ใจว่าได้เลือกค่าสัมประสิทธิ์อย่างถูกต้อง
สารออกซิไดซ์และรีดิวซ์ที่สำคัญที่สุด
คุณสมบัติรีดอกซ์ขององค์ประกอบขึ้นอยู่กับโครงสร้างของเปลือกอิเล็กทรอนิกส์ของอะตอมและถูกกำหนดโดยตำแหน่งในตารางธาตุของ Mendeleev
โลหะซึ่งมีอิเล็กตรอน 1-3 ตัวอยู่ที่ระดับพลังงานภายนอก ยอมปล่อยพวกมันได้ง่ายและแสดงเพียงคุณสมบัติลดลงเท่านั้น อโลหะ (องค์ประกอบของหมู่ IV-VII) สามารถบริจาคและรับอิเล็กตรอนได้ จึงสามารถแสดงคุณสมบัติทั้งรีดิวซ์และออกซิไดซ์ได้ ในช่วงที่เลขอะตอมขององค์ประกอบเพิ่มขึ้น คุณสมบัติรีดิวซ์ของสารเชิงเดี่ยวจะลดลง และคุณสมบัติออกซิไดซ์จะเพิ่มขึ้น ในกลุ่มที่มีหมายเลขลำดับเพิ่มขึ้น คุณสมบัติรีดิวซ์จะเพิ่มขึ้น และคุณสมบัติออกซิไดซ์อ่อนลง ดังนั้น, ของสารอย่างง่ายตัวรีดิวซ์ที่ดีที่สุดคือโลหะอัลคาไลอลูมิเนียมไฮโดรเจนคาร์บอน สารออกซิไดซ์ที่ดีที่สุดคือฮาโลเจนและออกซิเจน.
คุณสมบัติรีดอกซ์ของสารเชิงซ้อนขึ้นอยู่กับระดับของการเกิดออกซิเดชันของอะตอมที่ประกอบเป็นสารเหล่านั้น สารที่มีอะตอมที่มีสถานะออกซิเดชันต่ำที่สุดจะมีคุณสมบัติรีดิวซ์- สารรีดิวซ์ที่สำคัญที่สุดคือคาร์บอนมอนอกไซด์  ,ไฮโดรเจนซัลไฟด์
,ไฮโดรเจนซัลไฟด์  , เหล็ก(II) ซัลเฟต
, เหล็ก(II) ซัลเฟต  .สารที่มีอะตอมที่มีสถานะออกซิเดชันสูงสุดจะแสดงคุณสมบัติออกซิไดซ์- สารออกซิไดซ์ที่สำคัญที่สุดคือโพแทสเซียมเปอร์แมงกาเนต
.สารที่มีอะตอมที่มีสถานะออกซิเดชันสูงสุดจะแสดงคุณสมบัติออกซิไดซ์- สารออกซิไดซ์ที่สำคัญที่สุดคือโพแทสเซียมเปอร์แมงกาเนต  , โพแทสเซียม ไดโครเมต
, โพแทสเซียม ไดโครเมต  ,ไฮโดรเจนเปอร์ออกไซด์
,ไฮโดรเจนเปอร์ออกไซด์  ,กรดไนตริก
,กรดไนตริก  ,กรดซัลฟิวริกเข้มข้น
,กรดซัลฟิวริกเข้มข้น  .
.
สารที่มีอะตอมซึ่งมีสถานะออกซิเดชันระดับกลางสามารถทำหน้าที่เป็นตัวออกซิไดซ์หรือตัวรีดิวซ์ได้ขึ้นอยู่กับคุณสมบัติของสารที่พวกมันทำปฏิกิริยาและสภาวะของปฏิกิริยา จึงมีปฏิกิริยาโต้ตอบด้วย  กรดซัลฟูรัสมีคุณสมบัติลด:
กรดซัลฟูรัสมีคุณสมบัติลด:
และเมื่อทำปฏิกิริยากับไฮโดรเจนซัลไฟด์จะเป็นตัวออกซิไดซ์:

นอกจากนี้สำหรับสารดังกล่าวปฏิกิริยาออกซิเดชั่น - รีดิวซ์ตัวเองสามารถทำได้โดยเกิดขึ้นพร้อมกับการเพิ่มขึ้นและลดลงในสถานะออกซิเดชันของอะตอมขององค์ประกอบเดียวกันเช่น:
ความแข็งแรงของสารออกซิไดซ์และตัวรีดิวซ์หลายชนิดขึ้นอยู่กับค่า pH ของตัวกลาง ตัวอย่างเช่น, 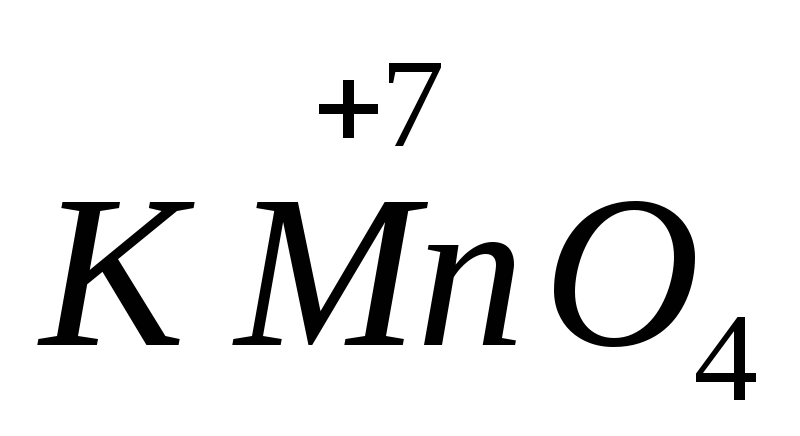 ในสภาพแวดล้อมที่เป็นด่างจะลดลงเหลือ
ในสภาพแวดล้อมที่เป็นด่างจะลดลงเหลือ  เป็นกลางถึง
เป็นกลางถึง  ต่อหน้ากรดซัลฟิวริก - มากถึง
ต่อหน้ากรดซัลฟิวริก - มากถึง  .
.
โดยมีอาจารย์เป็นแกนหลัก นักแสดงชายในการจัดกิจกรรมการเรียนรู้ของนักเรียน มักจะมองหาวิธีปรับปรุงประสิทธิผลของการเรียนรู้อย่างต่อเนื่อง องค์กร การเรียนรู้ที่มีประสิทธิภาพเป็นไปได้เฉพาะเมื่อมีความรู้และทักษะในการใช้กระบวนการสอนรูปแบบต่างๆ
1. คนทันสมัยต้องไม่เพียงแต่มีความรู้และทักษะเท่านั้น แต่ยังมีความสามารถในการรับรู้โลกโดยรวมที่ซับซ้อนและพัฒนาอยู่ตลอดเวลา
ดาวน์โหลด:
ดูตัวอย่าง:
บทความเคมี: “การจัดเรียงสัมประสิทธิ์ในสมการเคมี”
เรียบเรียงโดย: ครูเคมี
โรงเรียนมัธยม GBOU ลำดับที่ 626
คาซูติน่า โอ.พี.
มอสโก 2012
“การจัดเรียงสัมประสิทธิ์ในสมการเคมี”
ครูซึ่งเป็นตัวละครหลักในการจัดกิจกรรมการเรียนรู้ของนักเรียน มักจะมองหาวิธีปรับปรุงประสิทธิผลของการเรียนรู้อยู่ตลอดเวลา การจัดการเรียนการสอนที่มีประสิทธิภาพเป็นไปได้เฉพาะเมื่อมีความรู้และทักษะในการใช้กระบวนการสอนรูปแบบต่างๆ
1. คนสมัยใหม่ไม่เพียงต้องมีความรู้และทักษะเท่านั้น แต่ยังมีความสามารถในการรับรู้โลกเป็นหนึ่งเดียว ซับซ้อน และมีการพัฒนาอยู่ตลอดเวลา
อัลกอริทึมสำหรับการเตรียมตัวสำหรับบทเรียน
การเลือกหัวข้อ การกำหนดเป้าหมาย
การเลือกเนื้อหา
การระบุวิธีการและวิธีการพัฒนาทัศนคติเชิงบวกของนักเรียนต่อการทำงานในห้องเรียน
ข้อกำหนดในการเตรียมบทเรียนด้วยสื่อการสอนและภาพที่จำเป็น
การพัฒนาแผนการสอน
ตัวอย่างบทเรียนเคมี “การจัดเรียงสัมประสิทธิ์ในสมการเคมี” สำหรับครู
เป้า: ตอบคำถาม: “ทำไมคุณต้องใส่สัมประสิทธิ์ในสมการเคมี?”
งาน:
ปัญหาความจำเป็นในการกำหนดค่าสัมประสิทธิ์
อัลกอริทึมสำหรับการตั้งค่าสัมประสิทธิ์
พิสูจน์ความหมายของการจัดเรียงสัมประสิทธิ์
ความคืบหน้าของบทเรียน:
หากเขาศึกษา นักเรียนยุคใหม่ก็จะปฏิบัติต่อความรู้ที่เขาได้รับและประมวลผลด้วยลัทธิปฏิบัตินิยม ดังนั้นเนื้อหาที่จัดไว้ให้ควรพอดีกับหัวของคุณอย่างมีเหตุผลและรัดกุม
เพื่อให้บรรลุเป้าหมายนี้ ครูควรให้ความสนใจอยู่เสมอเพื่ออะไร จะต้องเรียนรู้การกระทำอย่างใดอย่างหนึ่งในชั้นเรียน นั่นคือครูต้องอธิบาย แล้วในทางที่ดีก็รอก่อน คำถามที่ถูกต้องในหัวข้อใหม่
กฎการอนุรักษ์มวลของสาร
อาร์. บอยล์ นักเคมีชื่อดังชาวอังกฤษ โต้กลับอย่างเปิดเผย โลหะต่างๆและชั่งน้ำหนักก่อนและหลังการให้ความร้อน ฉันพบว่ามวลของโลหะมีขนาดใหญ่ขึ้น จากการทดลองเหล่านี้ เขาไม่ได้คำนึงถึงบทบาทของอากาศและสรุปไม่ถูกต้องว่ามวลของสารเป็นผลให้ ปฏิกิริยาเคมีการเปลี่ยนแปลง อาร์ บอยล์แย้งว่ามี "สสารไฟ" บางชนิด ซึ่งเมื่อโลหะถูกทำให้ร้อน จะรวมตัวกับโลหะ ซึ่งจะทำให้มวลของมันเพิ่มขึ้น
มก. + โอ 2 MgO
24 ก. 40 ก
M.V. Lomonosov ซึ่งแตกต่างจาก R. Boyle โลหะเผาไม่อยู่ที่ กลางแจ้งและปิดผนึกและชั่งน้ำหนักก่อนและหลังการเผา เขาพิสูจน์ว่ามวลของสารก่อนและหลังปฏิกิริยายังคงไม่เปลี่ยนแปลง และในระหว่างการเผาอากาศบางส่วนจะถูกเติมเข้าไปในโลหะ (ในขณะนั้นยังไม่มีการค้นพบออกซิเจน) เขากำหนดผลลัพธ์ของการทดลองเหล่านี้ในรูปของกฎ: “การเปลี่ยนแปลงทั้งหมดที่เกิดขึ้นในธรรมชาติล้วนเป็นสภาวะที่ว่าสิ่งใดก็ตามที่พรากไปจากร่างหนึ่งจะถูกบวกเข้ากับอีกร่างหนึ่ง” ขณะนี้กฎหมายนี้มีการกำหนดดังนี้:
มวลของสารที่เกิดปฏิกิริยาเคมีจะเท่ากับมวลของสารที่เกิดขึ้น
มก. + โอ 2 MgO
24 ก. 32 ก. 40 ก
คำถาม: กฎหมายไม่เป็นไปตามนั้น (เนื่องจากมวลของสารตั้งต้นและสารสุดท้ายไม่เท่ากัน)
วิธีแก้ปัญหานี้คือการจัดเรียงสัมประสิทธิ์ (จำนวนเต็มระบุจำนวนโมเลกุล):
2มก. + โอ 2 2มกโอ
48 กรัม 32 กรัม 80 กรัม – มวลก่อนและหลังปฏิกิริยาจะเท่ากัน เนื่องจากจำนวนอะตอมของธาตุทั้งก่อนและหลังปฏิกิริยาเท่ากัน
ดังนั้น เมื่อพิสูจน์ให้นักเรียนเห็นถึงความจำเป็นในการปรับค่าสัมประสิทธิ์มวลให้เท่ากัน คุณสามารถทำได้โดยไม่ต้องมีหัวข้อก่อนหน้านี้: การเขียนสูตรสำหรับสารตามความจุ การคำนวณมวล ปริมาณของสาร... นอกจากนี้ยังมีเรื่องราวเกี่ยวกับความจริงที่ว่ากฎหมาย การอนุรักษ์มวลของสสารถูก "ค้นพบใหม่" ในอีก 20 ปีต่อมาโดย A. Lavoisier โดยได้ชี้แจงในด้านหนึ่ง แต่ไม่สนใจ M.V. Lomonosov ด้วยจริยธรรมคุณสามารถทิ้งไว้ที่ การศึกษาด้วยตนเองในรูปแบบรายงาน เป็นต้น
ดังนั้น เพื่อให้งานประเภทนี้สำเร็จลุล่วงได้ จำเป็นต้องเข้าใจเงื่อนไข: จำนวนอะตอมก่อนปฏิกิริยา db เท่ากับจำนวนอะตอมหลังปฏิกิริยา: มาแก้กัน:
ช 2 ส + 3O 2 ดังนั้น 2 + 2H 2 O (เราเพิ่มออกซิเจนเป็นสองเท่าทางด้านขวา เรานับมันทางด้านซ้าย)
CH 4 + 2O 2 CO 2 + 2H 2 O
เราได้ใส่ค่าสัมประสิทธิ์ไว้ในสมการการเผาไหม้ของก๊าซสองชนิด
ช่วงของค่าสัมประสิทธิ์
จำนวนอะตอมขององค์ประกอบหนึ่งทางด้านซ้ายของสมการจะต้องเท่ากับจำนวนอะตอมขององค์ประกอบนั้นที่อยู่ทางด้านขวาของสมการ
ภารกิจที่ 1 (สำหรับกลุ่ม)กำหนดจำนวนอะตอมขององค์ประกอบทางเคมีแต่ละชนิดที่มีส่วนร่วมในปฏิกิริยา
1. คำนวณจำนวนอะตอม:
ก) ไฮโดรเจน: 8NH3, NaOH, 6NaOH, 2NaOH, H3PO4, 2H2SO4, 3H2S04, 8H2SO4;
6) ออกซิเจน: C02, 3C02, 2C02, 6CO, H2SO4, 5H2SO4, 4H2S04, HN03.
2. คำนวณจำนวนอะตอม: ก)ไฮโดรเจน:
1) NaOH + HCl 2)CH4+H20 3)2Na+H2
b) ออกซิเจน:
1) 2СО + 02 2) С02 + 2Н.О 3)4NO2 + 2H2O + O2
อัลกอริธึมในการจัดเรียงสัมประสิทธิ์ในสมการปฏิกิริยาเคมี
А1 + О2→ А12О3A1-1 อะตอม A1-2
O-2 อะตอม O-3
2. ท่ามกลางองค์ประกอบด้วย ตัวเลขที่แตกต่างกันอะตอมทางด้านซ้ายและ ชิ้นส่วนที่ถูกต้องให้เลือกอันที่มีจำนวนอะตอมมากกว่า
อะตอม O-2 ทางด้านซ้าย
อะตอม O-3 ทางด้านขวา
3. ค้นหาตัวคูณร่วมน้อย (LCM) ของจำนวนอะตอมขององค์ประกอบนี้ทางด้านซ้ายของสมการ และจำนวนอะตอมขององค์ประกอบนี้ทางด้านขวาของสมการ
ล.ซม. = 6
4. หาร LCM ด้วยจำนวนอะตอมขององค์ประกอบนี้ทางด้านซ้ายของสมการ จะได้ค่าสัมประสิทธิ์ทางด้านซ้ายของสมการ
6:2 = 3
อัล + โซ 2 →อัล 2 เกี่ยวกับ 3
5. หาร LCM ด้วยจำนวนอะตอมขององค์ประกอบนี้ทางด้านขวาของสมการ จะได้ค่าสัมประสิทธิ์ทางด้านขวาของสมการ
6:3 = 2
A1+ โอ 2 →2A1 2 O3
6. หากค่าสัมประสิทธิ์ที่ตั้งไว้เปลี่ยนจำนวนอะตอมขององค์ประกอบอื่น ให้ทำซ้ำขั้นตอนที่ 3, 4, 5 อีกครั้ง
A1 + โซ 2 → →2А1 2 เกี่ยวกับ 3
A1 -1 อะตอม A1 - 4
ล.ซม. = 4
4:1=4 4:4=1
4A1 + โซ 2 → →2A1 2 เกี่ยวกับ 3
. การทดสอบการได้มาซึ่งความรู้เบื้องต้น (8-10 นาที .).
มีอะตอมออกซิเจน 2 อะตอมทางด้านซ้ายของแผนภาพ และอีก 1 อะตอมอยู่ทางด้านขวา จำนวนอะตอมจะต้องเท่ากันโดยใช้สัมประสิทธิ์
1)2มก.+O2 →2MgO
2) CaCO3 + 2HCl→CaCl2 + เอ็น2 โอ + โค2
ภารกิจที่ 2 ใส่ค่าสัมประสิทธิ์ลงในสมการของปฏิกิริยาเคมี (โปรดทราบว่าค่าสัมประสิทธิ์จะเปลี่ยนจำนวนอะตอมขององค์ประกอบเดียวเท่านั้น):
1. เฟ 2 โอ 3 + ก ล → ก ล 2 เกี่ยวกับ 3 + เฟ; มก.+เอ็น 2 → มก 3 เอ็น 2 ;
2. อัล + เอส → อัล 2 ส 3 - A1+ กับ → อัล 4 ค 3 ;
3. อัล + Cr 2 โอ 3 → Cr+อัล 2 โอ 3 - แคลเซียม+พี → แคลิฟอร์เนีย 3 ป 2 ;
4. ซี + ชม 2 → ช 4 ; แคลิฟอร์เนีย + ซี → SaS 2 ;
5. เฟ + โอ 2 → เฟ 3 โอ 4 - ศรี + มก → มก 2 ศรี;
6/.นา+ส → นา 2 เอส; CaO+ กับ → ซีเอซี 2 + คาร์บอนไดออกไซด์;
7.แคลเซียม+เอ็น 2 → ค ก 3 เอ็น 2 - ซิ+คลี 2 → SiCl 4 ;
8. เอจี+เอส → อจ 2 เอส; เอ็น 2 + กับ ล 2 → NS ลิตร;
9.น 2 + โอ 2 → เลขที่; บจก 2 + กับ → บจก ;
10. สวัสดี → เอ็น 2 → + 1 2 - มก.+ NS ล → MgCl 2 + เอ็น 2 ;
11. เฟเอส+ NS 1 → FeCl 2 +ฮ 2 เอส; สังกะสี+HCl → สังกะสี 2 +ฮ 2 ;
12. บ 2 +คิ → เคบีอาร์+ ไอ 2 - ศรี+HF (ร) → ซิฟ 4 +ฮ 2 ;
1./เอชซีแอล+นา 2 บจก 3 → บจก 2 +ฮ 2 O+ โซเดียมคลอไรด์; เคซีแอลโอ 3 +ส → → KCl+SO 2 ;
14. Cl 2 + เคบีอาร์ → KCl + Br 2 - SiO 2 + กับ → ศรี + CO;
15. ซีโอ 2 + กับ → SiC + CO; มก. + SiO 2 → มก 2 ศรี + MgO
16 .
3.เครื่องหมาย “+” ในสมการหมายถึงอะไร
4. เหตุใดจึงใส่สัมประสิทธิ์ในสมการเคมี?




