Aranjarea coeficienților în ecuații chimice. Chimie la școală
Există mai multe metode pentru determinarea coeficienților în ecuațiile reacțiilor redox. Folosim metoda echilibrului electronic, în care compilarea ecuației complete OVR se realizează în următoarea secvență:
1. Întocmește o diagramă de reacție, indicând substanțele care au reacționat și substanțele rezultate în urma reacției, de exemplu:
2. Determinați starea de oxidare a atomilor și scrieți semnul și valoarea acesteia deasupra simbolurilor elementelor, notând elementele a căror stare de oxidare s-a schimbat:
3. Notați ecuațiile electronice pentru reacțiile de oxidare și reducere, determinați numărul de electroni donați de agentul reducător și acceptați de agentul de oxidare, apoi egalizați-i prin înmulțirea cu coeficienții corespunzători:
4. Coeficienții obținuți corespunzători balanței electronice se transferă în ecuația principală:
5. Egalizează numărul de atomi și ioni care nu modifică starea de oxidare (în secvență: metale, nemetale, hidrogen):
6. Verificați corectitudinea selecției coeficienților pe baza numărului de atomi de oxigen din partea stângă și dreaptă a ecuației de reacție - aceștia ar trebui să fie egali (în această ecuație 24 = 18 + 2 + 4, 24 = 24).
Să ne uităm la un exemplu mai complex:
Să determinăm stările de oxidare ale atomilor din molecule:
Să creăm ecuații electronice pentru reacțiile de oxidare și reducere și să egalăm numărul de electroni dați și acceptați:
Să transferăm coeficienții în ecuația principală:
Să egalăm numărul de atomi care nu schimbă starea de oxidare:
Numărând numărul de atomi de oxigen din partea dreaptă și stângă a ecuației, ne vom asigura că coeficienții sunt aleși corect.
Cei mai importanți agenți oxidanți și reducători
Proprietățile redox ale elementelor depind de structura învelișului electronic al atomilor și sunt determinate de poziția lor în tabelul periodic al lui Mendeleev.
Metalele, având 1-3 electroni la nivelul energetic exterior, renunță la ei cu ușurință și prezintă doar proprietăți reducătoare. Nemetalele (elementele grupelor IV-VII) pot dona și accepta electroni, astfel încât pot prezenta atât proprietăți reducătoare, cât și oxidante. În perioadele cu creșterea numărului atomic al unui element, proprietățile reducătoare ale substanțelor simple slăbesc, iar proprietățile oxidante cresc. În grupurile cu număr de serie în creștere, proprietățile reducătoare cresc, iar proprietățile oxidante slăbesc. Astfel, dintre substanțele simple, cei mai buni agenți reducători sunt metalele alcaline, aluminiul, hidrogenul, carbonul; cei mai buni agenți oxidanți sunt halogenii și oxigenul.
Proprietățile redox ale substanțelor complexe depind de gradul de oxidare al atomilor care le alcătuiesc. Substanțele care conțin atomi cu cea mai scăzută stare de oxidare prezintă proprietăți reducătoare. Cei mai importanți agenți reducători sunt monoxidul de carbon  , hidrogen sulfurat
, hidrogen sulfurat  , sulfat de fier (II).
, sulfat de fier (II).  .Substanțele care conțin atomi cu cea mai mare stare de oxidare prezintă proprietăți oxidante. Cei mai importanți agenți oxidanți sunt permanganatul de potasiu
.Substanțele care conțin atomi cu cea mai mare stare de oxidare prezintă proprietăți oxidante. Cei mai importanți agenți oxidanți sunt permanganatul de potasiu  , dicromat de potasiu
, dicromat de potasiu  , peroxid de hidrogen
, peroxid de hidrogen  , acid azotic
, acid azotic  , acid sulfuric concentrat
, acid sulfuric concentrat  .
.
Substanțele care conțin atomi cu stări intermediare de oxidare se pot comporta ca agenți oxidanți sau reducătoriîn funcţie de proprietăţile substanţelor cu care interacţionează şi de condiţiile de reacţie. Deci în reacție cu  acidul sulfuros prezintă proprietăți reducătoare:
acidul sulfuros prezintă proprietăți reducătoare:
iar atunci când interacționează cu hidrogenul sulfurat este un agent oxidant:

În plus, pentru astfel de substanțe, sunt posibile reacții de autooxidare-autoreducere, care au loc cu o creștere și o scădere simultană a stării de oxidare a atomilor aceluiași element, de exemplu:
Puterea multor agenți oxidanți și reducători depinde de pH-ul mediului. De exemplu, 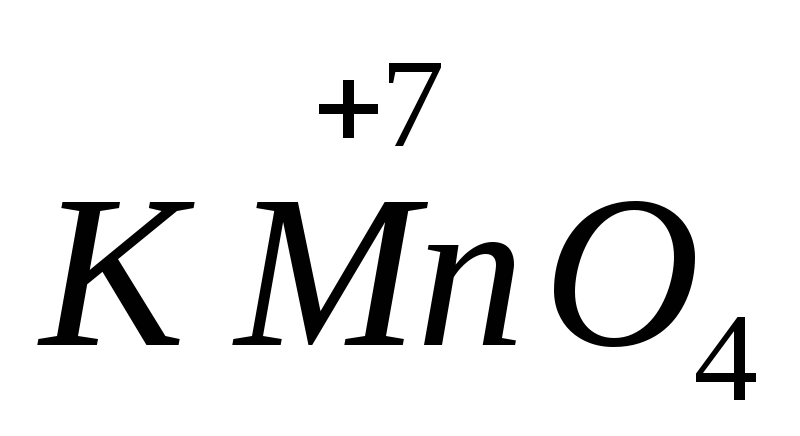 într-un mediu alcalin se reduce la
într-un mediu alcalin se reduce la  , în neutru la
, în neutru la  , în prezența acidului sulfuric - până la
, în prezența acidului sulfuric - până la  .
.
Cea mai simplă ecuație de reacție este:
Fe + S => FeS
Trebuie să puteți nu numai să scrieți ecuația reacției, ci și să o citiți. Această ecuație, în forma sa cea mai simplă, se citește astfel: o moleculă de fier interacționează cu o moleculă de sulf, rezultând o moleculă de sulfură de fier.
Cel mai dificil lucru în scrierea unei ecuații de reacție este de a crea formule pentru produsele de reacție, de exemplu. substanțe formate. Există o singură regulă aici: formulele moleculelor sunt construite strict în funcție de valența elementelor lor constitutive.
În plus, la alcătuirea ecuațiilor de reacție, trebuie să ne amintim legea conservării masei substanțelor: toți atomii din moleculele substanțelor inițiale trebuie să fie incluși în moleculele produselor de reacție. Nici un atom nu ar trebui să dispară sau să apară pe neașteptate. Prin urmare, uneori, după ce ați scris toate formulele din ecuația de reacție, trebuie să egalizați numărul de atomi din fiecare parte a ecuației - setați coeficienții. Iată un exemplu:
C + O 2 => CO 2Aici, fiecare element are același număr de atomi atât pe partea dreaptă cât și pe partea stângă a ecuației. Ecuația este gata.
Cu+O 2 => CuO
Și aici sunt mai mulți atomi de oxigen în partea stângă a ecuației decât în dreapta. Este necesar să se obțină atât de multe molecule de oxid de cupru
CuO , astfel încât să conțină același număr de atomi de oxigen, adică 2. Prin urmare, formulaCuO setați coeficientul 2:Cu+O2 => 2 CuO
Acum numărul de atomi de cupru nu este același. În partea stângă a ecuației, înaintea semnului de cupru punem coeficientul 2:
2 Cu + O2 => 2 CuO
Numărați dacă există un număr egal de atomi ai fiecărui element din stânga și părțile potrivite ecuații Dacă da, atunci ecuația reacției este corectă.
Un alt exemplu: Al+O 2 = Al 2 O 3
Și aici sunt atomii fiecărui element cantități diferiteînainte și după reacție. Începem să nivelăm cu gaz - cu molecule de oxigen:
1) Stânga 2 atomi de oxigen, iar în dreapta sunt 3. Căutăm cel mai mic multiplu comun al acestor două numere. Acest cel mai mic număr, care este divizibil cu 2 și 3, adică 6. Înainte de formulele de oxigen și oxid de aluminiuAl 2 O 3 Setăm coeficienții astfel încât număr totalÎn aceste molecule erau 6 atomi de oxigen:
Al+ 3 O 2= 2Al2O 3
2) Numărăm numărul de atomi de aluminiu: în stânga este 1 atom, iar în dreapta sunt 2 atomi în două molecule, adică 4. Înainte de semnul de aluminiu din partea stângă a ecuației punem coeficientul 4:
4Al + 3O 2 => 2 Al2O3
3) Încă o dată numărăm toți atomii înainte și după reacție: 4 atomi de aluminiu și 6 atomi de oxigen fiecare.
Totul este în ordine, ecuația reacției este corectă. Și dacă reacția are loc atunci când este încălzită, atunci un semn suplimentar este plasat deasupra săgeții t.
Ecuația unei reacții chimice este o înregistrare a progresului unei reacții chimice folosind formule și coeficienți chimici.
Instrucţiuni
Înainte de a începe sarcina în sine, trebuie să înțelegeți că numărul care este pus în față element chimic sau întreaga formulă a coeficientului. Și cifra merită (și puțin) indicele. Pe lângă asta, că:
Coeficientul se aplică tuturor simbolurilor chimice care apar după el în formulă
Coeficientul se înmulțește cu indicele (nu se adună!)
Numărul de atomi ai fiecărui element al substanțelor care intră în reacție trebuie să coincidă cu numărul de atomi ai acestor elemente incluși în produșii de reacție.
De exemplu, scrierea formulei 2H2SO4 înseamnă 4 atomi de H (hidrogen), 2 atomi de S (sulf) și 8 atomi de O (oxigen).
1. Exemplul nr. 1. Luați în considerare arderea etilenei.
Când materia organică arde, se formează monoxid de carbon (IV) ( dioxid de carbon) și apă. Să încercăm coeficienții succesiv.
C2H4 + O2 => CO2+ H2O
Să începem să analizăm. 2 atomi de C (carbon) au intrat în reacție, dar s-a obținut doar 1 atom, ceea ce înseamnă că punem 2 în fața CO2. Acum numărul lor este același.
C2H4 + O2 => 2CO2+ H2O
Acum să ne uităm la H (hidrogen). 4 atomi de hidrogen au intrat în reacție, dar rezultatul a fost doar 2 atomi, prin urmare, punem 2 în fața H2O (apă) - acum obținem și 4
C2H4 + O2 => 2CO2+ 2H2O
Numărăm toți atomii de O (oxigen) formați ca rezultat al reacției (adică după egalitate). 4 atomi în 2CO2 și 2 atomi în 2H2O - un total de 6 atomi. Și înainte de reacție sunt doar 2 atomi, ceea ce înseamnă că punem 3 în fața moleculei de oxigen O2, ceea ce înseamnă că sunt și 6 dintre ei.
C2H4 + 3O2 => 2CO2+ 2H2O
Așa s-a dovedit aceeași sumă atomii fiecărui element înainte și după semnul egal.
C2H4 + 3O2 => 2CO2+ 2H2O
2. Exemplul nr. 2. Luați în considerare reacția aluminiului cu acid sulfuric diluat.
Al + H2SO4 => Al2 (SO4) 3 + H2
Ne uităm la atomii de S care fac parte din Al2 (SO4) 3 - sunt 3, dar în H2SO4 (acid sulfuric) există doar 1, prin urmare, punem și 3 în fața acidului sulfuric.
Al + 3H2SO4 => Al2 (SO4) 3 + H2
Dar acum sunt 6 atomi de H (hidrogen) înainte de reacție și doar 2 după reacție, ceea ce înseamnă că punem și 3 în fața moleculei de H2 (hidrogen), astfel încât în total obținem 6.
Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
În cele din urmă, ne uităm la. Deoarece există doar 2 atomi de aluminiu în Al2 (SO4) 3 (sulfat de aluminiu), punem 2 în fața lui Al (aluminiu) înainte de reacție.
2Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Acum numărul tuturor atomilor înainte și după reacție este același. S-a dovedit că stabilirea coeficienților în ecuatii chimice nu chiar atât de greu. Doar exersează și totul se va rezolva.
Asigurați-vă că rețineți că coeficientul este înmulțit cu indicele și nu se adaugă.
Surse:
- cum reacţionează elementele
- Test pe tema „Ecuații chimice”
Pentru mulți școlari, scrieți ecuații reactii chimiceși plasați-l corect cote nici o sarcină ușoară. Mai mult, din anumite motive, principala dificultate pentru ei este tocmai a doua parte a acesteia. S-ar părea că nu este nimic complicat în asta, dar uneori elevii renunță, căzând într-o confuzie completă. Dar trebuie doar să vă amintiți câteva reguli simple, iar sarcina nu va mai cauza dificultăți.
Instrucţiuni
Coeficient, adică numărul din fața formulei unei molecule chimice, la toate simbolurile, și se înmulțește cu fiecare simbol! Se înmulțește, nu se adună! Poate părea incredibil, dar unii studenți adaugă două numere în loc să le înmulțească.
Numărul de atomi ai fiecărui element al substanțelor inițiale (adică situat în partea stângă a ecuației) trebuie să coincidă cu numărul de atomi ai fiecărui element al produselor de reacție (respectiv, situat în partea dreaptă a acestuia).
Profesorul, fiind principalul actorîn organizarea activității cognitive a elevilor, caută constant modalități de îmbunătățire a eficienței învățării. Organizare învăţare eficientă este posibilă numai cu cunoașterea și utilizarea cu pricepere a diferitelor forme ale procesului pedagogic.
1. Omul modern trebuie să aibă nu doar o sumă de cunoștințe și abilități, ci și capacitatea de a percepe lumea ca un întreg unic, complex, în continuă evoluție.
Descărcați:
Previzualizare:
Articol despre chimie: „Dispunerea coeficienților în ecuații chimice”
Alcătuit de: profesor de chimie
Școala Gimnazială GBOU Nr. 626
Kazutina O.P.
Moscova 2012
„Dispunerea coeficienților în ecuații chimice”
Profesorul, fiind personajul principal în organizarea activității cognitive a elevilor, caută în permanență modalități de îmbunătățire a eficienței învățării. Organizarea învățării eficiente este posibilă numai cu cunoașterea și utilizarea abil a diferitelor forme ale procesului pedagogic.
1. O persoană modernă trebuie să aibă nu doar o sumă de cunoștințe și abilități, ci și capacitatea de a percepe lumea ca un întreg unic, complex, în continuă evoluție.
Algoritm de pregătire pentru o lecție
alegerea unui subiect, definirea scopurilor;
selectarea conținutului;
identificarea mijloacelor și modalităților de a dezvolta atitudinea motivațională pozitivă a elevilor față de munca la clasă;
precizarea dotarii lectiei cu materialul vizual si didactic necesar;
dezvoltarea planului de lecție
Exemplu de lecție de chimie „Aranjarea coeficienților într-o ecuație chimică” pentru profesori
Ţintă: răspunde la întrebarea: „de ce trebuie să plasezi coeficienți într-o ecuație chimică?”
Sarcini:
Problema necesității atribuirii coeficienților
Algoritm pentru stabilirea coeficienților
Dovada semnificației aranjamentului coeficienților
Progresul lecției:
Un student modern, dacă învață, tratează cunoștințele pe care le primește și le prelucrează cu pragmatism. Prin urmare, materialul oferit ar trebui să se încadreze în capul tău logic și concis.
Pentru a realiza acest lucru, profesorul ar trebui să acorde întotdeauna atenție Pentru ce o acţiune sau alta trebuie învăţată la clasă. Adică profesorul trebuie să explice. Și apoi, în sensul bun, așteptați întrebările potrivite pe un subiect nou.
Legea conservării masei substanțelor
Celebrul chimist englez R. Boyle, calcinând într-o replică deschisă diverse metaleși cântărindu-le înainte și după încălzire, am descoperit că masa metalelor a devenit mai mare. Pe baza acestor experimente, el nu a ținut cont de rolul aerului și a ajuns la concluzia incorectă că masa substanțelor se modifică în urma reacțiilor chimice. R. Boyle a susținut că există un fel de „materie de foc”, care, atunci când un metal este încălzit, se combină cu metalul, crescându-i masa.
Mg + O 2 MgO
24 g 40 g
M.V. Lomonosov, spre deosebire de R. Boyle, metalele calcinate nu la în aer liber, și în retorte sigilate și le-a cântărit înainte și după calcinare. El a demonstrat că masa substanțelor înainte și după reacție rămâne neschimbată și că în timpul calcinării o parte din aer este adăugată metalului. (Oxigenul nu fusese încă descoperit în acel moment.) El a formulat rezultatele acestor experimente sub forma unei legi: „Toate schimbările care au loc în natură sunt astfel de stări încât orice este luat dintr-un corp este adăugat la altul”. În prezent, această lege este formulată astfel:
Masa substanțelor care au intrat într-o reacție chimică este egală cu masa substanțelor formate
Mg + O 2 MgO
24 g 32 g 40 g
Întrebare: legea nu este îndeplinită (întrucât masele substanțelor inițiale și finale nu sunt egale).
Soluția la această problemă este aranjarea coeficienților (numere întregi care indică numărul de molecule):
2Mg + O 2 2MgO
48 g 32 g 80 g – masele înainte și după sunt egale datorită faptului că și numărul de atomi ale elementelor este egal înainte și după reacție.
Astfel, după ce le-a demonstrat elevilor necesitatea egalizării coeficienților de masă, poți chiar să faci fără unele dintre subiectele anterioare: întocmirea unor formule pentru substanțe după valență, calculul masei, cantității de substanță... De asemenea, o poveste despre faptul că legea de conservare a masei de materie a fost „redescoperit” 20 de ani mai târziu de către A. Lavoisier, clarificându-l pe de o parte, dar fără a acorda complet atenție lui M.V. Lomonosov cu etica, o puteți lăsa la auto-studiu sub forma unui raport, de exemplu.
Deci, pentru a finaliza cu succes sarcini de acest fel, trebuie să înțelegeți condiția: numărul de atomi înainte de reacție db este egal cu numărul de atomi după reacție: să rezolvăm împreună:
H 2 S + 3O 2 SO 2 + 2H 2 O (dublem oxigenii în dreapta. Îi numărăm în stânga)
CH 4 + 2O 2 CO 2 + 2H 2 O
Am plasat coeficienții în ecuațiile de ardere a două gaze
L  Este ușor să plasați coeficienți în ecuațiile chimice?
Este ușor să plasați coeficienți în ecuațiile chimice?
Deci copiii mei au crescut la chimie (I profesor de clasăîn nota 8 „B”). Chimia este predată de cele mai multe ori copiilor în prima lecție, dar joi nu am avut prima lecție și am cerut să merg la lecția Valentinei Ivanovna să „mă uit la copii” și să verific jurnalele. Subiectul m-a fascinat la școală, mi-a plăcut chimia și nu am verificat jurnalele. Încă o dată, am fost convins că studenții întâmpină cel mai adesea dificultăți din cauza faptului că nu văd conexiuni interdisciplinare. În această lecție de chimie, elevilor li s-a cerut să creeze ecuații chimice bazate pe valența substanțelor chimice. Și mulți studenți au avut dificultăți în determinarea coeficienților numerici. Valentina Ivanovna și cu mine am avut împreună următoarea lecție de chimie sâmbătă.
Exercițiul 1.
Scrieți următoarele propoziții sub formă de ecuații chimice:
A) „La arderea carbonatului de calciu se formează oxid de calciu și monoxid de carbon (IV)”; b) „Când oxidul de fosfor (V) reacționează cu apa, se obține acid fosforic.”
Soluţie:
A) CaCO 3 = CaO + CO 2 - reacția este endotermă. Nu au existat dificultăți cu această sarcină, deoarece nu a fost nevoie să se caute coeficienți numerici. Inițial, părțile stânga și dreaptă ale ecuației conțin un atom de calciu, un atom de carbon și trei atomi de oxigen.
B) P 2 O 5 + 3H 2 O = 2H 3 PO 4 - reacţia este exotermă. Au fost probleme cu a doua ecuație fără coeficienți numerici, egalitatea corectă nu a funcționat: P 2 O 5 + H 2 O → H 3 PO 4 . Evident, pentru a întocmi o egalitate corectă, trebuie să selectați coeficienți numerici. Dacă selectați, puteți începe cu fosfor: sunt doi atomi în stânga și unul în dreapta, așa că înainte de formula acidului azotic punem un factor numeric egal cu doi și apoi obținem: P 2 O 5 + H 20 → 2H3PO4. Dar acum rămâne să egalăm numărul de atomi de oxigen și hidrogen: sunt doi atomi de hidrogen în stânga și șase atomi în dreapta, așa că înainte de formula apei punem un coeficient numeric egal cu trei și apoi obținem: P 2O5 + 3H2O → 2H3PO4. Acum este ușor de verificat că în fiecare parte a ecuației există cantități egale de atomi de fosfor, atomi de hidrogen și atomi de oxigen, prin urmare, am obținut ecuația corectă pentru reacția chimică: P 2 O 5 + 3H 2 O = 2H 3 PO 4.
A doua cale: algebric. Să presupunem că punem trei coeficienți în ecuație a, b, c , că s-a obținut ecuația corectă a reacției chimice: O P2O5+ V H2O= Cu H3PO4. Deoarece ecuația folosește trei tipuri de atomi, vom crea un sistem de trei ecuații liniare cu trei necunoscute a, cŞi Cu .
Substante care au fost folosite in reactia chimica: P – fosfor; O 2 – oxigen; P 2 O 5 – oxid de fosfor (V).
B) Fe 2 (SO 4 ) 3 + KOH → Fe (OH) 3 + K 2 SO 4.
Substanțe care au fost utilizate în reacția chimică: Fe 2 (SO 4) 3 – sulfat de fier (III); KOH – hidroxid de potasiu; Fe(OH) 3 – hidroxid de fier (III); K 2 SO 4 – sulfat de potasiu.
D) CuOH → Cu2O + H2O.
Soluţie: 2CuOH = Cu 2 O + H 2 O. Problema determinării coeficienților numerici a fost rezolvată prin alcătuirea unui sistem de ecuații: 
Substanțe care au fost utilizate în reacția chimică: CuOH – hidroxid de cupru (I); Cu 2 O – oxid de cupru (I); H2O – apă.
D) CS 2 + O 2 → CO 2 + SO 2.
Soluţie: CS2 + 3O2 = CO2 + 2SO2. Am rezolvat prin selectarea coeficienților: am egalat numărul de atomi de sulf (2); a egalat numărul de atomi de oxigen (3).
Substanțe care au fost utilizate în reacția chimică: CS 2 – sulfură de sulf (IV); O 2 –
Substante care au fost folosite in reactia chimica: FeS 2 – pirita; O 2 – oxigen; Fe 2 O 3 – oxid de fier (III); SO 2 - oxid de sulf (IV).
Exercițiul 3.
(A fost propus spre rezolvare ca o lucrare separată).
Stare:
Scrieți ecuațiile reacțiilor chimice după următoarele scheme:
A) acid fosforic + hidroxid de sodiu → fosfat de sodiu + apă;
B) oxid de sodiu + apă → hidroxid de sodiu;
B) oxid de fier (II) + aluminiu → oxid de aluminiu + fier;
D) hidroxid de cupru (II) → oxid de cupru (II) + apă.
Răspuns:
A) 2H3P04 + 6NaOH = 2Na3P04 + 6H20;
B) Na20 + H20 = 2NaOH;
B) 3FeO + 2Al = Al203 + 3Fe;
D) Cu(OH)2 = CuO + H2O.
În 10 minute, 85% dintre elevi au finalizat sarcina „excelent”, ceea ce a surprins-o plăcut pe Valentina Ivanovna.




