Formula de eliberare a căldurii. Cantitatea de căldură
« Fizica - clasa a X-a"
În ce procese au loc transformări agregate ale materiei?
Cum se poate schimba starea de agregare a unei substanțe?
Puteți schimba energia internă a oricărui corp lucrând, încălzindu-l sau, dimpotrivă, răcindu-l.
Deci, la forjarea unui metal, se lucrează și acesta se încălzește, în același timp metalul poate fi încălzit peste o flacără care arde.
De asemenea, dacă fixați pistonul (Fig. 13.5), atunci volumul de gaz nu se modifică atunci când este încălzit și nu se lucrează. Dar temperatura gazului și, prin urmare, energia sa internă, crește.
Energia internă poate crește și scădea, astfel încât cantitatea de căldură poate fi pozitivă sau negativă.
Se numește procesul de transfer de energie de la un corp la altul fără a lucra schimb de căldură.
Măsura cantitativă a modificării energiei interne în timpul transferului de căldură se numește cantitatea de căldură.
Imaginea moleculară a transferului de căldură.
În timpul schimbului de căldură la granița dintre corpuri, are loc interacțiunea moleculelor care se mișcă lentă ale unui corp rece cu moleculele care se mișcă rapid ale unui corp fierbinte. Ca urmare, energiile cinetice ale moleculelor sunt egalizate și vitezele moleculelor unui corp rece cresc, iar cele ale unui corp fierbinte scad.
În timpul schimbului de căldură, energia nu este convertită dintr-o formă în alta, o parte din energia internă a unui corp mai încălzit este transferată într-un corp mai puțin încălzit.
Cantitatea de căldură și capacitatea de căldură.
Știți deja că pentru a încălzi un corp de masă m de la temperatura t 1 la temperatura t 2, este necesar să îi transferați o cantitate de căldură:
Q = cm(t 2 - t 1) = cm Δt. (13,5)
Când un corp se răcește, temperatura sa finală t 2 se dovedește a fi mai mică decât temperatura inițială t 1 și cantitatea de căldură degajată de corp este negativă.
Se numește coeficientul c din formula (13.5). capacitate termică specifică substante.
Căldura specifică- aceasta este o cantitate egală numeric cu cantitatea de căldură pe care o primește sau o eliberează o substanță cu greutatea de 1 kg atunci când temperatura sa se schimbă cu 1 K.
Capacitatea termică specifică a gazelor depinde de procesul prin care are loc transferul de căldură. Dacă încălziți un gaz la presiune constantă, acesta se va extinde și va funcționa. Pentru a încălzi un gaz cu 1 °C la presiune constantă, trebuie să transfere mai multă căldură decât să-l încălzească la un volum constant, când gazul se va încălzi doar.
Lichidele și solidele se extind ușor când sunt încălzite. Capacitățile lor specifice de căldură la volum constant și presiune constantă diferă puțin.
Căldura specifică de vaporizare.
Pentru a transforma un lichid în abur în timpul procesului de fierbere, trebuie să i se transfere o anumită cantitate de căldură. Temperatura unui lichid nu se schimbă atunci când fierbe. Transformarea unui lichid în vapori la o temperatură constantă nu duce la o creștere a energiei cinetice a moleculelor, ci este însoțită de o creștere a energiei potențiale a interacțiunii lor. La urma urmei, distanța medie dintre moleculele de gaz este mult mai mare decât între moleculele lichide.
O cantitate egală numeric cu cantitatea de căldură necesară pentru a transforma un lichid care cântărește 1 kg în abur la o temperatură constantă se numește căldură specifică vaporizare.
Procesul de evaporare a unui lichid are loc la orice temperatură, în timp ce cele mai rapide molecule părăsesc lichidul, iar acesta se răcește în timpul evaporării. Căldura specifică de evaporare este egală cu căldura specifică de vaporizare.
Această valoare este notată cu litera r și exprimată în jouli pe kilogram (J/kg).
Căldura specifică de vaporizare a apei este foarte mare: r H20 = 2,256 10 6 J/kg la o temperatură de 100 °C. Pentru alte lichide, de exemplu alcool, eter, mercur, kerosen, căldura specifică de vaporizare este de 3-10 ori mai mică decât cea a apei.
Pentru a transforma un lichid cu masa m în vapori, este necesară o cantitate de căldură egală cu:
Q p = rm. (13,6)
Când aburul se condensează, se eliberează aceeași cantitate de căldură:
Q k = -rm. (13,7)
Căldura specifică de fuziune.
Când un corp cristalin se topește, toată căldura furnizată acestuia duce la creșterea energiei potențiale de interacțiune între molecule. Energia cinetică a moleculelor nu se modifică, deoarece topirea are loc la o temperatură constantă.
O valoare egală numeric cu cantitatea de căldură necesară pentru a transforma o substanță cristalină care cântărește 1 kg la punctul de topire într-un lichid se numește căldură specifică de fuziuneși notat cu litera λ.
Când o substanță care cântărește 1 kg cristalizează, se eliberează exact aceeași cantitate de căldură cu cea absorbită în timpul topirii.
Căldura specifică de topire a gheţii este destul de mare: 3,34 10 5 J/kg.
„Dacă gheața nu ar avea o căldură mare de fuziune, atunci în primăvară întreaga masă de gheață ar trebui să se topească în câteva minute sau secunde, deoarece căldura este transferată continuu către gheață din aer. Consecințele acestui lucru ar fi cumplite; la urma urmei, chiar și în situația actuală, atunci când mase mari de gheață sau zăpadă se topesc, apar inundații mari și fluxuri puternice de apă.” R. Black, secolul XVIII.
Pentru a topi un corp cristalin de masa m, este necesară o cantitate de căldură egală cu:
Qpl = λm. (13,8)
Cantitatea de căldură eliberată în timpul cristalizării unui corp este egală cu:
Q cr = -λm (13,9)
Ecuaţie echilibru termic.
Să luăm în considerare schimbul de căldură în cadrul unui sistem format din mai multe corpuri care au inițial temperaturi diferite, de exemplu, schimbul de căldură între apa dintr-un vas și o minge fierbinte de fier coborâtă în apă. Conform legii conservării energiei, cantitatea de căldură degajată de un corp este numeric egală cu cantitatea de căldură primită de altul.
Cantitatea de căldură dată este considerată negativă, cantitatea de căldură primită este considerată pozitivă. Prin urmare, cantitatea totală de căldură Q1 + Q2 = 0.
Dacă schimbul de căldură are loc între mai multe corpuri dintr-un sistem izolat, atunci
Q 1 + Q 2 + Q 3 + ... = 0. (13.10)
Ecuația (13.10) se numește ecuația de echilibru termic.
Aici Q 1 Q 2, Q 3 sunt cantitățile de căldură primite sau degajate de corpuri. Aceste cantități de căldură sunt exprimate prin formula (13.5) sau formulele (13.6)-(13.9), dacă în timpul procesului de schimb de căldură au loc diferite transformări de fază ale substanței (topire, cristalizare, vaporizare, condensare).
După cum se știe, în timpul diferitelor procese mecanice are loc o schimbare a energiei mecanice. O măsură a schimbării energiei mecanice este munca forțelor aplicate sistemului:
În timpul schimbului de căldură, are loc o schimbare a energiei interne a corpului. O măsură a schimbării energiei interne în timpul transferului de căldură este cantitatea de căldură.
Cantitatea de căldură este o măsură a modificării energiei interne la care un corp o primește (sau renunță) în timpul procesului de schimb de căldură.
Astfel, atât munca cât și cantitatea de căldură caracterizează schimbarea energiei, dar nu sunt identice cu energia. Ele nu caracterizează starea sistemului în sine, ci determină procesul de tranziție a energiei de la un tip la altul (de la un corp la altul) atunci când starea se schimbă și depind semnificativ de natura procesului.
Principala diferență dintre muncă și cantitatea de căldură este că munca caracterizează procesul de modificare a energiei interne a unui sistem, însoțită de transformarea energiei de la un tip la altul (din mecanic în intern). Cantitatea de căldură caracterizează procesul de transfer al energiei interne de la un corp la altul (de la mai încălzit la mai puțin încălzit), neînsoțit de transformări energetice.
Experiența arată că cantitatea de căldură necesară pentru a încălzi un corp de masă m de la temperatură la temperatură se calculează prin formula
unde c - căldură specifică substanțe;
![]()
Unitatea SI a capacității termice specifice este joule pe kilogram Kelvin (J/(kg K)).
Căldura specifică c este numeric egal cu cantitatea de căldură care trebuie transmisă unui corp care cântărește 1 kg pentru a-l încălzi cu 1 K.
Capacitate termica corpul este numeric egal cu cantitatea de căldură necesară pentru a modifica temperatura corpului cu 1 K:
![]()
Unitatea SI a capacității de căldură a unui corp este joule pe Kelvin (J/K).
Pentru a transforma un lichid în abur la o temperatură constantă, este necesar să consumați o cantitate de căldură
unde L este căldura specifică de vaporizare. Când aburul se condensează, se eliberează aceeași cantitate de căldură.
Conceptul cantității de căldură s-a format în primele etape ale dezvoltării fizicii moderne, când nu existau idei clare despre structura internă substanțele, ce este energia, ce forme de energie există în natură și energia ca formă de mișcare și transformare a materiei.
Cantitatea de căldură înseamnă mărime fizică echivalent cu energia transferată unui corp material în procesul de schimb de căldură.
Unitatea de căldură învechită este caloria, egală cu 4,2 J astăzi practic nu este folosită, iar joule i-a luat locul;
Inițial, s-a presupus că purtătorul de energie termică era un mediu complet lipsit de greutate, cu proprietățile unui lichid. Numeroase probleme fizice ale transferului de căldură au fost și sunt încă rezolvate pe baza acestei premise. Existența caloricului ipotetic a stat la baza multor construcții esențial corecte. Se credea că caloriile sunt eliberate și absorbite în fenomenele de încălzire și răcire, topire și cristalizare. Ecuațiile corecte pentru procesele de transfer de căldură au fost obținute pe baza unor concepte fizice incorecte. Există o lege cunoscută conform căreia cantitatea de căldură este direct proporțională cu masa corpului care participă la schimbul de căldură și cu gradientul de temperatură:
Unde Q este cantitatea de căldură, m este masa corporală și coeficientul Cu– o cantitate numită capacitate termică specifică. Capacitatea termică specifică este o caracteristică a unei substanțe implicate într-un proces.
Lucru în termodinamică
Ca urmare a proceselor termice, curatati lucru mecanic. De exemplu, atunci când un gaz se încălzește, acesta își mărește volumul. Să luăm o situație precum imaginea de mai jos:

ÎN în acest caz, lucrul mecanic va fi egal cu forța presiunii gazului asupra pistonului înmulțită cu calea parcursă de piston sub presiune. Desigur asta cel mai simplu caz. Dar chiar și în ea se poate observa o dificultate: forța de presiune va depinde de volumul gazului, ceea ce înseamnă că nu avem de-a face cu constante, ci cu cantități variabile. Deoarece toate cele trei variabile: presiunea, temperatura și volumul sunt legate între ele, calculul muncii devine semnificativ mai complicat. Există câteva procese ideale, infinit de lente: izobare, izoterme, adiabatice și izocorice - pentru care astfel de calcule pot fi efectuate relativ simplu. Un grafic al presiunii în funcție de volum este reprezentat grafic și lucrul este calculat ca o integrală a formei.
Puteți modifica energia internă a gazului din cilindru nu numai lucrând, ci și încălzind gazul (Fig. 43). Dacă fixați pistonul, volumul gazului nu se va schimba, dar temperatura și, prin urmare, energia internă va crește.
Procesul de transfer de energie de la un corp la altul fără a lucra se numește schimb de căldură sau transfer de căldură.
Energia transferată organismului ca rezultat al schimbului de căldură se numește cantitatea de căldură. Cantitatea de căldură se mai numește și energia pe care o degajă un corp în timpul schimbului de căldură.
Imaginea moleculară a transferului de căldură.În timpul schimbului de căldură la limita dintre corpuri, are loc interacțiunea moleculelor care se mișcă lentă ale unui corp rece cu moleculele care se mișcă mai rapid ale unui corp fierbinte. Ca urmare, energiile cinetice ale moleculelor sunt egalizate și vitezele moleculelor unui corp rece cresc, iar cele ale unui corp fierbinte scad.
În timpul schimbului de căldură, energia nu este convertită dintr-o formă în alta: o parte din energia internă a corpului fierbinte este transferată în corpul rece.
Cantitatea de căldură și capacitatea de căldură. Din cursul de fizică clasa a VII-a se știe că pentru a încălzi un corp de masă m de la temperatura t 1 la temperatura t 2 este necesar să se informeze despre cantitatea de căldură.
Q = cm(t 2 – t 1) = cmΔt. (4,5)
Când un corp se răcește, temperatura sa eternă t 2 este mai mică decât temperatura inițială t 1 și cantitatea de căldură degajată de corp este negativă.
Coeficientul c din formula (4.5) se numește capacitate termică specifică
. Capacitatea termică specifică este cantitatea de căldură pe care 1 kg dintr-o substanță o primește sau o eliberează atunci când temperatura acesteia se schimbă cu 1 K.
Capacitatea termică specifică este exprimată în jouli împărțit la kilogram înmulțit cu kelvin. Corpuri diferite necesită cantități diferite de energie pentru a crește temperatura cu 1 K. Astfel, capacitatea termică specifică a apei este de 4190 J/(kg K), iar cea a cuprului este de 380 J/(kg K).
Capacitatea termică specifică depinde nu numai de proprietățile substanței, ci și de procesul prin care are loc transferul de căldură. Dacă încălziți un gaz la presiune constantă, acesta se va extinde și va funcționa. Pentru a încălzi un gaz cu 1°C la presiune constantă, va trebui să i se transfere mai multă căldură decât pentru a-l încălzi la volum constant.
Lichid și solide se extind ușor atunci când sunt încălzite, iar capacitățile termice specifice ale acestora la volum constant și presiune constantă diferă puțin.
Căldura specifică de vaporizare. Pentru a transforma un lichid în abur, trebuie transferată o anumită cantitate de căldură. Temperatura lichidului nu se modifică în timpul acestei transformări. Transformarea unui lichid în vapori la o temperatură constantă nu duce la o creștere a energiei cinetice a moleculelor, ci este însoțită de o creștere a energiei potențiale a acestora. La urma urmei, distanța medie dintre moleculele de gaz este de multe ori mai mare decât între moleculele lichide. În plus, o creștere a volumului în timpul tranziției unei substanțe de la starea lichidă la starea gazoasă necesită muncă împotriva forțelor externe de presiune.
Cantitatea de căldură necesară pentru a transforma 1 kg de lichid în abur la o temperatură constantă se numește căldură specifică de vaporizare.
Căldura specifică de vaporizare a apei este foarte mare: 2.256 · 10 6 J/kg la o temperatură de 100°C. Pentru alte lichide (alcool, eter, mercur, kerosen etc.) căldura specifică de vaporizare este de 3-10 ori mai mică.
Pentru a transforma un lichid cu masa m în vapori, este necesară o cantitate de căldură egală cu:
Când aburul se condensează, se eliberează aceeași cantitate de căldură
Q k = –rm. (4,7)
Căldura specifică de fuziune. Când un corp cristalin se topește, toată căldura furnizată acestuia duce la creșterea energiei potențiale a moleculelor. Energia cinetică a moleculelor nu se modifică, deoarece topirea are loc la o temperatură constantă.
Cantitatea de căldură λ (lambda) necesară pentru a transforma 1 kg dintr-o substanță cristalină la punctul de topire într-un lichid la aceeași temperatură se numește căldură specifică de fuziune.
Când 1 kg dintr-o substanță cristalizează, se eliberează exact aceeași cantitate de căldură. Căldura specifică de topire a gheții este destul de mare: 3,4 · 10 5 J/kg.
Pentru a topi un corp cristalin de masa m, este necesară o cantitate de căldură egală cu:
Qpl = λm. (4,8)
Cantitatea de căldură eliberată în timpul cristalizării unui corp este egală cu:
Q cr = – λm. (4,9)
1. Cum se numește cantitatea de căldură? 2. De ce depinde capacitatea termică specifică a substanțelor? 3. Cum se numește căldura specifică de vaporizare? 4. Cum se numește căldura specifică de fuziune? 5. În ce cazuri este negativă cantitatea de căldură transferată?
730. De ce se folosește apa pentru a răci unele mecanisme?
Apa are o capacitate termică specifică mare, ceea ce ajută retragere bună căldură de la mecanism.
731. În ce caz este necesar să cheltuiți mai multă energie: să încălziți un litru de apă cu 1 °C sau să încălziți o sută de grame de apă cu 1 °C?
Pentru a încălzi un litru de apă, cu cât masa este mai mare, cu atât mai multă energie trebuie cheltuită.
732. Furculițe din argint cupronichel și argint de masă egală au fost coborâte în apă fierbinte. Vor primi aceeași cantitate de căldură din apă?
O furcă cu cupronicel va primi mai multă căldură, deoarece căldura specifică a cupronicelului este mai mare decât cea a argintului.
733. O bucată de plumb și o bucată de fontă de aceeași masă au fost lovite de trei ori cu un baros. Care piesa a devenit mai fierbinte?
Plumbul va deveni mai fierbinte deoarece capacitatea sa de căldură specifică este mai mică decât fonta și este nevoie de mai puțină energie pentru a încălzi plumbul.
734. Un balon conține apă, celălalt conține kerosen de aceeași masă și temperatură. Un cub de fier la fel de încălzit a fost aruncat în fiecare balon. Ce se va încălzi mai mult temperatură ridicată– apă sau kerosen?
Kerosenul.
735. De ce sunt fluctuațiile de temperatură iarna și vara mai puțin accentuate în orașele de pe malul mării decât în orașele situate în interior?
Apa se încălzește și se răcește mai lent decât aerul. Iarna, se răcește și mută masele de aer cald pe uscat, făcând clima de pe coastă mai caldă.
736. Capacitatea termică specifică a aluminiului este de 920 J/kg °C. Ce înseamnă acest lucru?
Aceasta înseamnă că pentru a încălzi 1 kg de aluminiu cu 1 °C este necesar să cheltuiți 920 J.
737. Barele de aluminiu și cupru de aceeași masă 1 kg se răcesc la 1 °C. Cât de mult se va schimba energia internă a fiecărui bloc? Pentru ce bară se va schimba mai mult și cu cât?
738. Ce cantitate de căldură este necesară pentru a încălzi un kilogram de țagle de fier cu 45 °C?

739. Ce cantitate de căldură este necesară pentru a încălzi 0,25 kg de apă de la 30 °C la 50 °C?

740. Cum se va schimba energia internă a doi litri de apă când sunt încălzite cu 5 °C?

741. Ce cantitate de căldură este necesară pentru a încălzi 5 g de apă de la 20 °C la 30 °C?
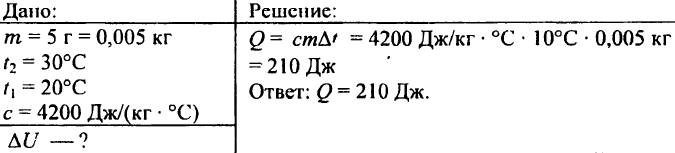
742. Ce cantitate de căldură este necesară pentru a încălzi o minge de aluminiu cu o greutate de 0,03 kg cu 72 °C?
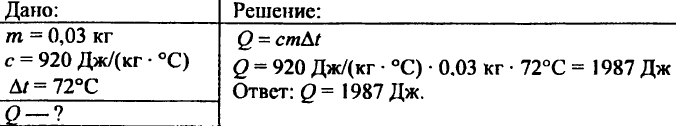
743. Calculați cantitatea de căldură necesară pentru a încălzi 15 kg de cupru la 80 °C.
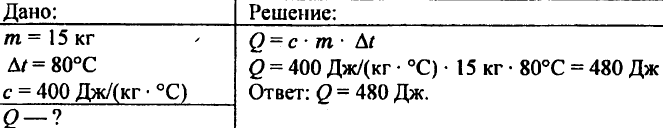
744. Calculați cantitatea de căldură necesară pentru a încălzi 5 kg de cupru de la 10 °C la 200 °C.

745. Ce cantitate de căldură este necesară pentru a încălzi 0,2 kg de apă de la 15 °C la 20 °C?

746. Apa care cântărește 0,3 kg s-a răcit cu 20 °C. Cât de mult a scăzut energia internă a apei?

747. Ce cantitate de căldură este necesară pentru a încălzi 0,4 kg de apă la o temperatură de 20 °C la o temperatură de 30 °C?

748. Ce cantitate de căldură se consumă pentru a încălzi 2,5 kg de apă cu 20 °C?
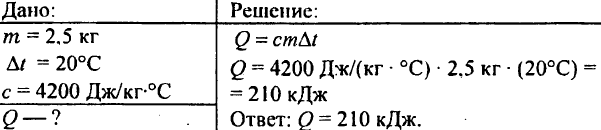
749. Ce cantitate de căldură a fost eliberată când 250 g de apă s-au răcit de la 90 °C la 40 °C?
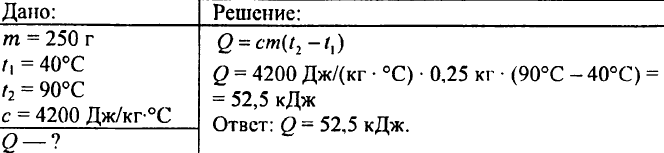
750. Ce cantitate de căldură este necesară pentru a încălzi 0,015 litri de apă cu 1 °C?

751. Calculați cantitatea de căldură necesară pentru a încălzi un iaz cu un volum de 300 m3 cu 10 °C?

752. Ce cantitate de căldură trebuie adăugată la 1 kg de apă pentru a-i crește temperatura de la 30 °C la 40 °C?

753. Apa cu un volum de 10 litri s-a răcit de la o temperatură de 100 °C la o temperatură de 40 °C. Câtă căldură a fost eliberată în acest timp?

754. Calculați cantitatea de căldură necesară pentru a încălzi 1 m3 de nisip cu 60 °C.

755. Volum aer 60 mc, capacitate termică specifică 1000 J/kg °C, densitate aer 1,29 kg/m3. Câtă căldură este necesară pentru a o ridica la 22°C?

756. Apa a fost încălzită la 10 °C, consumând 4,20 103 J de căldură. Determinați cantitatea de apă.
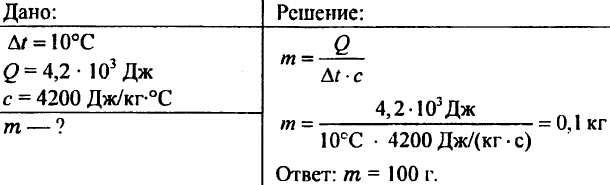
757. 20,95 kJ de căldură au fost transmise apei cu o greutate de 0,5 kg. Ce a devenit temperatura apei dacă temperatura inițială a apei a fost de 20 °C?

758. O tigaie de cupru cu o greutate de 2,5 kg se umple cu 8 kg de apă la 10 °C. Câtă căldură este necesară pentru a încălzi apa din tigaie până la fierbere?

759. Se toarnă un litru de apă la o temperatură de 15 °C într-un oală de cupru care cântărește 300 g Ce cantitate de căldură este necesară pentru a încălzi apa din oală la 85 °C?

760. Se pune în apă o bucată de granit încălzit de 3 kg. Granitul transferă 12,6 kJ de căldură în apă, răcindu-se cu 10 °C. Care este capacitatea termică specifică a pietrei?

761. S-a adăugat apă fierbinte la 50 °C la 5 kg apă la 12 °C, obținându-se un amestec cu temperatura de 30 °C. Câtă apă ai adăugat?

762. S-a adăugat apă la 20 °C la 3 litri de apă la 60 °C, obținându-se apă la 40 °C. Câtă apă ai adăugat?

763. Care va fi temperatura amestecului dacă amesteci 600 g apă la 80 °C cu 200 g apă la 20 °C?

764. Un litru de apă la 90 °C a fost turnat în apă la 10 °C, iar temperatura apei a devenit 60 °C. Câți au fost apa rece?

765. Stabiliți cât să turnați în vas apă fierbinte, încălzit la 60 °C, dacă vasul conține deja 20 de litri de apă rece la o temperatură de 15 °C; temperatura amestecului trebuie să fie de 40 °C.

766. Determinați câtă căldură este necesară pentru a încălzi 425 g de apă cu 20 °C.

767. Câte grade se vor încălzi 5 kg de apă dacă apa primește 167,2 kJ?

768. Câtă căldură este necesară pentru a încălzi m grame de apă la temperatura t1 la temperatura t2?
769. 2 kg de apă se toarnă într-un calorimetru la o temperatură de 15 °C. La ce temperatură se va încălzi apa calorimetrului dacă se coboară în ea o greutate de alamă de 500 g încălzită la 100 °C? Capacitatea termică specifică a alamei este de 0,37 kJ/(kg °C).
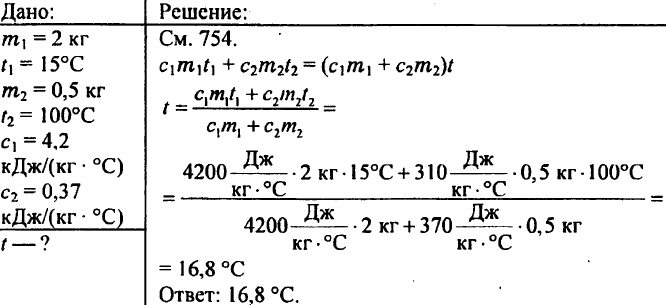
770. Sunt bucăți de cupru, cositor și aluminiu de același volum. Care dintre aceste piese are cea mai mare și care are cea mai mică capacitate de căldură?

771. S-au turnat în calorimetru 450 g apă, a cărei temperatură era de 20 °C. Când 200 g de pilitură de fier încălzită la 100 °C au fost scufundate în această apă, temperatura apei a devenit 24 °C. Determinați capacitatea termică specifică a rumegușului.

772. Un calorimetru de cupru care cântărește 100 g conține 738 g de apă, a cărei temperatură este de 15 °C. 200 g de cupru au fost coborâte în acest calorimetru la o temperatură de 100 °C, după care temperatura calorimetrului a crescut la 17 °C. Care este capacitatea termică specifică a cuprului?

773. Se scoate din cuptor o bila de otel cu greutatea de 10 g si se pune in apa la temperatura de 10 °C. Temperatura apei a crescut la 25 °C. Care era temperatura bilei în cuptor dacă masa de apă era de 50 g? Capacitatea termică specifică a oțelului este de 0,5 kJ/(kg °C).

777. 50 g de apă la 19 °C au fost turnate în apă cu o greutate de 150 g la o temperatură de 35 °C. Care este temperatura amestecului?

778. Apa cu greutatea de 5 kg la 90 °C a fost turnată într-un vas din fontă cu o greutate de 2 kg la o temperatură de 10 °C. Care era temperatura apei?

779. Un tăietor din oțel cu o greutate de 2 kg a fost încălzit la o temperatură de 800 °C și apoi coborât într-un vas care conținea 15 litri de apă la o temperatură de 10 °C. La ce temperatură se va încălzi apa din vas?

(Indicație: Pentru a rezolva această problemă, este necesar să se creeze o ecuație în care temperatura necunoscută a apei din vas după coborârea tăietorului este considerată necunoscută.)
780. Ce temperatură se va obține apa dacă amestecați 0,02 kg apă la 15 °C, 0,03 kg apă la 25 °C și 0,01 kg apă la 60 °C?

781. Pentru încălzirea unei clase bine ventilate, cantitatea de căldură necesară este de 4,19 MJ pe oră. Apa intră în caloriferele de încălzire la 80 °C și le lasă la 72 °C. Câtă apă ar trebui să fie furnizată caloriferelor la fiecare oră?

782. Plumbul cântărind 0,1 kg la o temperatură de 100 °C a fost scufundat într-un calorimetru de aluminiu cu o greutate de 0,04 kg care conținea 0,24 kg apă la o temperatură de 15 °C. După care temperatura din calorimetru a ajuns la 16 °C. Care este căldura specifică a plumbului?





